能力验证乳粉样品中双歧杆菌计数培养基的选择探究
劳嘉倩,蒋佳希*,尹玮璐(广州市食品检验所,广东广州 510410)
摘 要:目的:探讨能力验证中双歧杆菌计数培养基的选择及注意事项。方法:依据《食品安全国家标准 食品微生物学检验 双歧杆菌检验》(GB 4789.34—2016)和乳粉中乳酸菌检验能力验证[ACAS-PT926(2020)]参试指导书的要求,通过采用人员比对及不同培养基(MRS培养基、双歧杆菌培养基),比较分析双歧杆菌计数结果的差异性。结果:相同培养条件下,同一样品使用MRS培养基和双歧杆菌培养基,结果的再现性均较低,两种培养基的稳定性较好。同一样品在双歧杆菌培养基中的菌落计数均比MRS培养基高,但两者的再现性(r=0.17,r=0.21)均小于再现性限(r=0.45),表明两者的差异是可以接受的。结论:MRS培养基和双歧杆菌培养基均可作为双歧杆菌计数培养基,两者的稳定性均较好。在日常样品检验过程中,为了提高工作效率,可选用更为便捷的MRS培养基,若要尽可能多地计算样品中双歧杆菌含量,可选用BBL培养基进行培养计数。关键词:能力验证;双歧杆菌;培养基
双歧杆菌(Bifidobacterium)是一类严格厌氧的革兰氏阳性杆菌,广泛存在于人和动物体内,具有抗菌、抗感染、免疫调节、降低胆固醇、抗肿瘤等多种生理功能[1-4],是人体内重要的益生菌。目前,双歧杆菌在医学、功能性食品、保健食品等方面有较深入的研究,被广泛应用于各种乳制品中。
随着食品行业的快速发展,消费者对食品的安全性和质量要求越来越高,我国食品微生物标准《食品安全国家标准 婴儿配方食品》(GB 10765—2010)和《食品安全国家标准 较大婴儿和幼儿配方食品》(GB 10767—2010)中明确规定添加活性菌种的产品其活性益生菌的数量要≥106 CFU/mL,但要准确测定食品中双歧杆菌的含量,通常受测试环境、样品保存条件、样品均匀性、稀释体积、取样体积、培养时间、培养温度、观察计数等多方面因素的影响[4-8]。因此,科学、准确地测定产品中双歧杆菌等益生菌的数量十分关键。
能力验证是利用实验室间的比对判定实验室的特定校准、检测能力,以考察实验室检验技术能力的外部质量活动[9-10],在人员能力评估、数据准确性分析等方面具有重要意义[11-13]。为了更准确更科学全面的得出能力验证结果,本实验室依据《食品安全国家标准 食品微生物学检验 双歧杆菌检验》(GB 4789.34—2016),采用人员比对及MRS琼脂和双歧杆菌琼脂(BBL培养基)2种培养基对能力验证样品进行检测,通过比较分析不同培养基对双歧杆菌计算结果的差异,探究不同培养基的适用性,为实验室进行双歧杆菌计数培养提供培养基的选择参考。
1 材料与方法
1.1 样品
样品20-U983和20-Z259来源于中国检验检疫科学研究院测试评价中心。
1.2 仪器与试剂
Dilumat STRT重量稀释仪(法国biomerieux公司);Ⅱ级A2型生物安全柜(美国Thermo公司);Anoxomat Ⅲ 智能化厌氧系统(荷兰anoxomat公司);IF450 生化培养箱(德国memmert公司);MRS培养基(北京陆桥技术股份有限公司);双歧杆菌培养基(广东环凯微生物科技有限公司);0.85%生理盐水(实验室自制);西红柿浸出液(实验室自制)。
1.3 实验方法
本研究参照ACAS-PT926(2020)乳粉中乳酸菌检验能力验证参试指导书、GB 4789.34—2016方法操作,制备10倍系列稀释样品匀液至10-5。样品称量前要充分混匀,确保乳酸菌在样品中分布均匀。稀释过程中应充分均质拍打1~2 min,10倍系列稀释管注意要用旋涡振荡器混匀。在进行10倍递增稀释的同时,吸取10-3~10-5样品匀液1 mL于无菌平皿内,做2个平行平皿。及时将10~20 mL冷却至46~50 ℃的琼脂培养基倾注平皿,转动平皿使其混合均匀,于(36±1) ℃下厌氧培养48 h,计数平板上的所有菌落数。样品制备到平板倾注要求在15 min内完成。
分别选择BBL培养基和MRS培养基及3名检测员进行比对实验。
1.4 分析方法
实验结果采用重复性限、再现性限[14]进行分析。重复性为同一样品使用同一培养基,由同一操作者在短时间内进行的两次平行试验的结果,取以10为底的对数后,绝对值差值≤0.25(即重复性限,r=0.25)。再现性为同一样品使用不同培养基进行计数,同一操作者2次独立试验结果取以10为底的对数后,绝对值差值≤0.45(即再现性限,r=0.45)。人员比对再现性:同一样品使用同一培养基进行计数,由不同操作者进行的2次独立试验结果取以10为底的对数后,绝对值差值不大于0.45(即再现性限,r=0.45)。
2 结果与分析
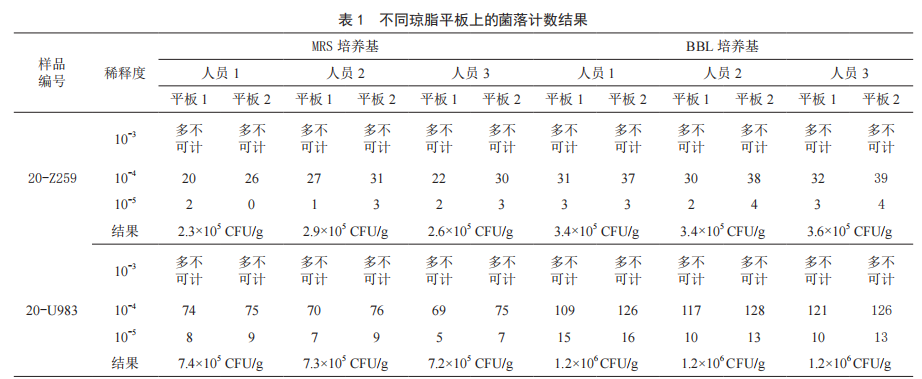
样品使用BBL培养基和MRS培养基经(36±1)℃厌氧培养48 h后,双歧杆菌数计数结果及计算见表1。
人员1的重复性分别为:r=0.11,r=0.08,r=0.01,r=0.06;
人员2的重复性分别为:r=0.06,r=0.10,r=0.04,r=0.04,人员3的重复性分别为:r=0.13r=0.09,r=0.04,r=0.02,均低于重复性限(r=0.25),重复性均较好。
样品Z259使用MRS培养基做人员比对,其再现性r=0.10,r=0.05,r=0.05;使用BBL培养基做人员比对,其再现性r=0,r=0.02,r=0.02。样品U983使用MRS培养基作人员比对,其再现性均为r=0.01,使用BBL培养基作人员比对,其再现性均为r=0。以上人员比对的再现性均低于再现性限r=0.45,表明两种培养基的稳定性均较好。最终选取人员1的计数结果进行分析及报告。
样品Z259取稀释度10-4进行菌落计数,在MRS培养基上的菌落计数取平均值后乘以稀释倍数,结果为2.3×105 CFU/g。在BBL培养基上的菌落计数取平均值后乘以稀释倍数,结果为3.4×105 CFU/g。样品Z259在BBL培养基上的菌落计数和在MRS培养基上的菌落计数的再现性r=0.17,小于再现性限(r=0.45),同一样品在2种培养基的计数结果之间的差值不明显。
样品U983取稀释度10-4进行菌落计数,在MRS培养基上的菌落计数取平均值后乘以稀释倍数,结果为7.4×105 CFU/g。在BBL培养基上的菌落计数取平均值后乘以稀释倍数,结果为1.2×106 CFU/g。样品U983在BBL培养基上的菌落计数和在MRS培养基上的菌落计数的再现性r=0.21,小于再现性限(r=0.45),表明2种培养基对同一样品的计数结果之间的差值是可以接受的。
3 结论与讨论
(1)本次能力验证乳粉样品中仅含有双歧杆菌,按照GB 4789.34—2016的标准要求对样品中双歧杆菌进行计数。本次能力验证为实验室间评定,因MRS培养基和BBL培养基的菌落计数差异不大,考虑到BBL培养基配制烦琐,多数实验室更倾向于使用较为便捷的MRS培养基,故本次结果报告取MRS培养基的菌落计数,20-Z259结果报告为2.3×105 CFU/g,20-U983结果报告为7.4×105 CFU/g,||值均小于2,结果均反馈为满意结果。
(2)实验所用的BBL培养基和MRS培养基均以蛋白胨作为氮源,葡萄糖或可溶性淀粉作为碳源,酵母提取物作为生长因子[15]。相同培养条件下,BBL培养基上的菌落数较MRS培养基多,可能是因为BBL培养基中含有半胱氨酸盐,能为双歧杆菌的生长提供更适宜的还原性环境(厌氧环境),BBL培养基额外添加了番茄汁作为天然营养物质,新鲜番茄汁富含多种维生素,能作为促进双歧杆菌生长的双歧增殖因子,提高双歧杆菌的生长活力[16-17]。研究表明[18],以3%马铃薯汁为碳源、3%黄豆汁为氮源、10%番茄汁作为生长因子,经37 ℃培养10 h后,活菌数比原MRS培养基增加了2.11倍。
(3)《食品安全国家标准 食品微生物学检验 双歧杆菌检验》(GB 4789.34—2016)中规定的双歧杆菌计数培养基为BBL培养基或MRS培养基,本次实验和相关文献均表明,相同培养条件下,BBL培养基上的活菌数较MRS培养基多,但两者的再现性(r=0.17,r=0.21)均低于再现性限(r=0.45),表明两者的差值明显。因此,在日常样品检验过程中,为了提高工作效率,实验室可选用更为便捷的MRS培养基,若要尽可能多地计算样品中双歧杆菌含量,可选用BBL培养基进行培养计数。
(4)对于能力验证中的实验室间评定,如果多数实验室都采用MRS培养基,只有个别实验室使用BBL培养基,则结果的中位值可能偏低,采用BBL培养基的实验室结果易会落于上四分位值上方,表现为离群值[19],影响实验室间评定结果的真实性与客观性。因此,对于能力验证中的实验室间评定,能力验证组织方可设置两组不同培养基的实验结果比对,以提高能力验证的客观性和真实性。
本实验通过选取2种培养基(MRS培养基和BBL培养基)对能力验证乳粉样品中双歧杆菌含量进行培养计数,发现BBL培养基的活菌数高于MRS培养基,但两者的再现性低于再现性限,MRS培养基和BBL培养基均可作为双歧杆菌计数培养基。在日常样品检验过程中,实验室可根据实验需求(便捷性需求或更接近真值需求),选取相应的计数培养基。
参考文献
[1]李吉平,陈雪,刘建华,等.双歧杆菌生物特性及其功能研究进展[J].中国奶牛,2020(6):57-61.
[2]杨淼,赵笑笑,宋馨,等.双歧杆菌的分离培养和生理功能研究进展[J].工业微生物,2020,50(4):45-51.
[3]张琳,徐加英,石羽杰,等.双歧杆菌BB-12及其免疫调节功能的研究进展[J].上海预防医学,2020,32(7):600-605.
[4]丁诗瑶,雷文平,刘成国,等.乳酸菌细胞表面结构与胃肠道的相互作用[J].食品与机械,2020,36(4):40-44.
[5]李宗瑾,王轶,郭晏强,等.城市和农村生活饮用水中菌落总数平皿计数法测量不确定度的A类和B类评定[J].医学动物防制,2021,37(3):303-305.
[6]李静芳,汤水平,唐小兰,等.奶粉大肠菌群检测中不确定度的评定[J].中国卫生检验杂志,2009,19(7):1477-1478.
[7]王海华,兰茜.能力验证菌落总数测定结果不确定度的评定[J].食品安全质量检测学报,2015,6(6):2352-2355.
[8]杨燕,李琼琼,宋光艳,等.能力验证乳粉中乳酸菌计数不确定度的评定[J].食品安全质量检测学报,2016,7(7):2747-2750.
[9]BSI Standards Publication.General requirements for the competence of testing and calibration laboratories:ISO/IEC 17025[S].The British Standards institution,2018-3-31
[10]芦云,王芳,金鑫.食品微生物学能力验证[J].检验检疫学刊,2013,23(2):44-47.
[11]贾东,李宏,王金玲,等.食品微生物学能力验证过程质量控制的研究[J].现代测量与实验室管理,2012,20(6):49-52.
[12]雷质文.食品微生物实验室质量管理手册[M].北京:中国标准出版社,2006.
[13]周黎明.质量控制技术[M].广州:广东经济出版,2003.
[14]ISO 4833:2003 Microbiology of food and animal feeding stuffs-Horizontal method for the enumeration of microorganisms-Colony-count techni queat 30 degrees C[EB/OL].(2003-02-01)[2021-05-13]https://www.iso.org/standard/34524.html
[15]王春耀,张德纯,朱辉,等.双歧杆菌番茄培养基的初步研究[J].中国微生态学杂志,2011,23(11):991-993.
[16]谭欢,侯爱香,周传云.乳酸菌高效增殖条件的探索[J].中国酿造,2007(5):49-52.
[17]孙媛媛,崔树茂,唐鑫,等.发酵乳杆菌的生长限制性因素分析及高密度培养工艺优化[J].食品与发酵工业,2021,47(6):1-10.
[18]杜磊,袁超,董亚敏.乳酸菌培养基的优化设计研究[J].黑龙江畜牧兽医,2017(7):165-168.
[19]吴孝槐.定量食品微生物能力验证统计方法比较研究[J].中国检验检测,2018,26(6):34-37.

相关热词搜索:
[责任编辑:]

 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论