全自动固相萃取-高效液相色谱-串联质谱法测定
全自动固相萃取-高效液相色谱-串联质谱法测定蜂蜜中4种吡咯里西啶类生物碱
朱秀焕1,郝胜玉2,玄红专3,常晨阳1,赵成新4,李爱峰5
(1.聊城海关,山东聊城 252000;2.聊城大学物理科学与信息工程学院,
山东聊城 252000;3.聊城大学生命科学学院,山东聊城 252000;
4.泰安海关,山东泰安 271000;5.聊城大学化学化工学院,山东聊城 252000)
摘 要:建立了全自动固相萃取-高效液相色谱-串联质谱测定蜂蜜中4种吡咯里西啶类生物碱(野百合碱、倒千里光碱、千里光宁、千里光菲啉)含量的方法。样品用50%甲醇水溶液提取,采用SCX固相萃取柱进行在线净化,以Agilent Eclipse Plus C18色谱柱为分析柱,含0.1%甲酸、10 mmol/L乙酸铵的水溶液和乙腈的流动相等度洗脱,在电喷雾电离源正离子模式和多反应监测模式下进行检测。结果表明,4种生物碱均在0.1~20 μg/kg范围内与其对应的峰面积呈现良好的线性关系,相关系数均大于0.999,方法的检出限(S/N=3)和定量限(S/N=10)分别为0.1μg/kg和0.2 μg/kg。以空白蜂蜜样品为基质,在1 μg/kg、2.5 μg/kg、5 μg/kg加标水平下做回收实验,回收率在83.98%~94.75%,相对标准偏差(RSD,n=6)均低于5%,该方法准确度高、灵敏度高、稳定性好、操作简便,适用于蜂蜜中吡咯里西啶类生物碱的测定。对国产20个不同产地、不同种类的蜂蜜样品进行测定,结果发现3个样品检出了倒千里光碱,1个样品检出了千里光菲啉,野百合碱和千里光宁均未检出。关键词:全自动固相萃取;高效液相色谱-串联质谱法;吡咯里西啶类生物碱;蜂蜜
蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然物质[1],是营养丰富的天然滋养食品。随着蜂蜜市场需求量的不断提高,蜂蜜的安全问题也日益严重,农药、兽药残留、掺杂、掺假等问题不断出现[2],严重影响了我国蜂蜜产品的市场秩序和出口贸易。
吡咯里西啶类生物碱(Pyrrolizidine Alkaloids,PAs)是一种在开花植物中广泛存在的毒性生物碱,其毒性表现在肝脏毒性、肾脏毒性、肺脏毒性、致癌作用等许多方面[3-5]。蜜蜂采集了这类植物的花蜜酿造出的蜂蜜含有PAs,给人类的健康带来潜在的威胁。近年来,GRIFFIN等[6]对59份澳大利亚蜂蜜样本进行分析,发现其中41份样品中含有PAs,这一研究报告使蜂蜜的质量问题再一次引起人们的关注。中国是全球最大的蜜蜂养殖国,蜂蜜的生产量和出口量稳居世界第一。蜂蜜是人体摄入PAs的重要途径之一,并且存在长期食用的可能性,其低水平、长期暴露的风险值得关注。鉴于PAs的广泛来源及强烈的毒性,建立蜂蜜及植物源性食品中PAs的检测方法及加强PAs的监测具有十分重要的意义。
现有的PAs的检测方法包括液相色谱法[7]、酶联免疫吸附分析[8]、气相色谱-质谱法[9]及液相色谱-质谱法[10-12]。高效液相色谱-串联质谱法结合了液相色谱高效的在线分离能力和质谱的高选择性、高灵敏度,具有同时检测多种不同性质目标物的能力,在药物多残留分析中显示出越来越广阔的应用前景,但该方法对样品的前处理要求比较高。有文献报道采用强阳离子型固相萃取柱净化蜂蜜样品[13],另外杜凤君等人采用了QuEChERS方法优化了蜂蜜中33种生物碱的净化方法[14]。但上述两种方法存在操作步骤烦琐耗时、测定成本高、净化效果不好等问题。近年来,由固相萃取发展而来的全自动萃取,采用全自动固相萃取装置的程序设置实现了全自动化的样品前处理过程,不仅可以解决传统固相萃取操作耗时的缺点,还可以减少人为误差[15-19]。
本文以蜂蜜基质中4种吡咯里西啶类生物碱(野百合碱、倒千里光碱、千里光宁、千里光菲啉)为研究对象,通过全自动固相萃取技术净化样品,采用高效液相色谱-串联质谱法(HPLC-MS/MS)同时测定,有效缩短了测定时间,为蜂蜜等植物源性产品中PAs的安全风险评估提供了技术支持。
1 材料与方法
1.1 仪器与试剂
Agilent 1260 高效液相色谱仪-6460三重四级杆串联质谱仪,美国Agilent公司;全自动固相萃取仪,美国莱伯泰科公司;涡旋混匀器,德国IKA公司;十万分之一分析天平,德国塞多利斯公司;高速冷冻离心机,日本日立公司。
野百合碱标准品(纯度>99%);倒千里光碱标准品(纯度>98%);千里光宁标准品(纯度>99%);千里光菲啉标准品(纯度>99%),均为美国Stanford公司;甲酸、甲醇、乙腈、乙酸铵,色谱纯,美国Fisher公司;去离子水,自制;强阳离子固相萃取柱(SCX,60 mg/3 mL)天津Agela公司;混合型阳离子交换固相萃取柱(CX,60 mg/3 mL),美国Ameritech公司;高聚物固相萃取柱(HLB,60 mg/3 mL),日本岛津公司;蜂蜜样品分别由贵州省农科院提供和购于当地超市。
1.2 实验方法
1.2.1 样品的前处理
(1)涡旋提取。准确称取蜂蜜样品2.0 g(精确至0.01 g)于50 mL带盖聚四氟乙烯离心管中,加入10 mL 50%甲醇水(/)溶液,3 000 r/min涡旋提取10 min,10 000 r/min离心5 min后取上清液,待净化。
(2)样品净化。采用全自动固相萃取仪设定洗脱程序,按设定程序净化样品。洗脱液用氮吹仪在45 ℃下吹干,加入1 mL 0.1%甲酸水溶液溶解残渣,过0.22 μm滤膜后上机检测。
1.2.2 分离及检测条件
(1)色谱分离条件。Agilent Eclipse Plus C18柱(100 mm×2.1 mm,3.5 μm);流动相:A(0.1%甲酸,10 mmol/L乙酸铵水溶液)︰B(乙腈)=86︰14(V/V);流速:0.4 mL/min;进样量10 μL;柱温30 ℃。
(2)质谱检测条件。扫描方式:电喷雾正离子扫描模式(ESI+);检测方式:多反应监测(MRM);毛细管电压:4 000 V;干燥气流速:11 L/min;雾化器温度:350 ℃;雾化器压力:310.26 kPa;4种PAs的质谱检测条件见表1。

2.1 样品前处理
向空白蜂蜜基质中加入4种PAs,使其浓度为10 μg/kg,以50%甲醇水溶液(V/V)为提取溶剂,确定涡旋提取时间为10 min。
2.2 固相萃取净化
采用全自动固相萃取仪设定洗脱程序,分别比较了3种固相萃取柱(SCX、CX、HLB)的净化效果,结果如图1所示,使用SCX固相萃取柱净化,PAs的回收率最高。另外利用全自动萃取技术可以真正做到不用人工动手的情况下完成相关工作,节约了人工时间,同时将实验中的误差降到了最低,比传统的人工操作方便且稳定性强,还更加环保。

2.3.1 色谱分离条件的优化
4种PAs的同时测定依赖于色谱柱的选择,不同类型的色谱柱对4种PAs的分离效果存在一定的差异。实验考察了Agilent Poroshell 120 EC-C18柱(100 mm×3.0 mm,2.7 μm)和Agilent Eclipse Plus C18柱(100 mm×2.1 mm,3.5 µm),部分PAs在Agilent Poroshell 120 EC-C18柱上拖尾严重,峰形不对称,分离效果不好。4种PAs 在Agilent Eclipse Plus C18柱上峰形对称尖锐,可以实现良好的分离。
2.3.2 质谱检测条件的优化
分别用0.1%甲酸溶液稀释4种PAs储备液,在正离子模式下进行母离子全扫描,确定待测物的母离子,再分别进行子离子全扫描。选择两个特征子离子,分别取信噪比高、峰形好看、干扰小的离子对作为定量离子对。以多反应监测正离子模式优化各个质谱参数,4种PAs混合物标准溶液的总离子图见图2。

2.4 标准曲线与线性范围
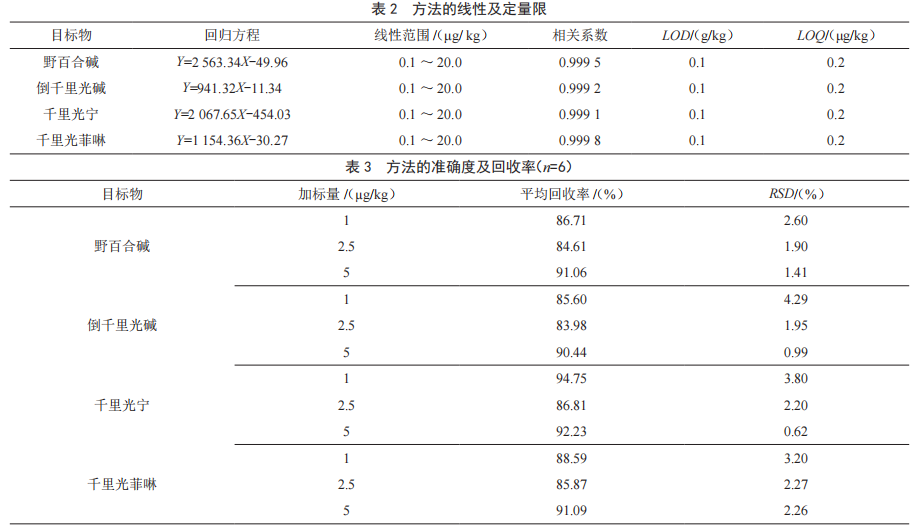
以0.1%甲酸溶液为定溶液,配制PAs的质量浓度为分别为0.1 μg/L、0.2 μg/L、0.5 μg/L、1.0 μg/L、2.0 μg/L、5.0 μg/L、10.0 μg/和20.0 μg/L的系列标准溶液,以信噪比(S/N)大于3确定为本方法的检出限,以信噪比(S/N)大于10,回收率大于60%的浓度点确定为本方法的定量限,方法的线性、检出限和定量限如表2所示。
2.5 准确度
向空白蜂蜜基质中按1 μg/kg、2.5 μg/kg、5 μg/kg这3个不同加标水平加入相应量的混合标准溶液,按优化的方法测定,计算加标回收率,如表3所示4种PAs的加标回收率在83.98%~94.75%,相对标准偏差(BSD,n=6)均低于5%,表明方法的准确度较高。
分别对20个不同产地、不同种类的蜂蜜样品中PAs的含量进行了测定,其中3个样品检出了倒千里光碱,含量分别为0.53 μg/kg、0.49 μg/kg、0.23 μg/kg,1个样品检出了千里光菲啉,含量为0.27 μg/kg,野百合碱和千里光宁均未检出。
本文建立了全自动固相萃取-高效液相色谱-串联质谱法测定蜂蜜中4种PAs,并用于实际样品的检测。结果表明该方法灵敏度高、回收率高、操作简便、定量准确、经济环保且高效稳定,适用于蜂蜜中PAs的测定,为蜂蜜中PAs的检测提供了一种高效简便的方法,可以为蜂蜜等植物源性产品中PAs的安全风险评估提供技术支持。
参考文献
[1]中华人民共和国卫生部.食品安全国家标准 蜂蜜:GB 14963—2011[S].北京:中国标准出版社,2011.
[2]NOORI A W,KHELOD S,AHMED A G,et al.Antibiotic,pesticide,and microbial contaminants of honey:human health hazards[J].The Scientific World Journal,2012:930849.
[3]JI L L,MA Y B,WANG Z Y,et al.Quercetin prevents pyrrolizidine alkaloid clivorine-induced liver injury in mice by elevating body defense capacity[J].PLoS One,2014,9(6):98970.
[4]DOMINIK S,PAUL A W,ZHU X C,et al.Metabolic profiling of pyrrolizidine alkaloids in Foliage of two Echium spp. Invaders in Australia-A Case of Novel Weapons?[J]International journal of molecular sciences,2015,16(11):26721-26737.
[5]BRUNO P S P,RAVENA P N,VICTOR D A S,et al.The role of astrocytes in metabolism and neurotoxicity of the pyrrolizidine alkaloid monocrotaline,the Main Toxin of Crotalaria retusa[J].Front Pharmacol,2012(3):144-150.
[6]CAROLINE T G,SIMON M M,MARTIN D,et al.Development of a fast isocratic LC-MS/MS method for the high-throughput analysis of pyrrolizidine alkaloids in Australian honey[J].Food Additive Contam aminants:Part A,2015,32(2):214-228.
[7]OPLATOWSKA M,ELLIOTT C T,HUET A C,et al.Development and validation of a rapid multiplex ELISA for pyrrolizidine alkaloids and their N-oxides in honey and feed[J].Analytical and Bioanalytical Chemistry,2014,406(3):757-770.
[8]MICHAEL K,SANDRA H,IRIS H,et al.Pyrrolizidine alkaloids in pollen and pollen products[J].Molecular Nutrition Food Research,2010,54(2):292-300.
[9]熊爱珍,杨莉,张芳,等.LC-MSn鉴定肝毒性吡咯里西啶类生物碱千里光碱大鼠体内代谢产物[J].中国药学杂志,2012,47(1):54-60.
[10]张芳,王长虹,王峥涛.植物中吡咯吡咯里西啶类生物碱的检测与分析[J].天然产物研究与开发,2006(6):1057-1063.
[11]LIU F,WAN S Y,JIANG Z J,et al.Determination of pyrrolizidine alkaloids in comfrey by liquid chromatography-electrospray ionization mass spectrometry[J].Talanta,2009,80(2):916-923.
[12]DUBECKE A,BECKH G,LULLMANN C.Pyrrolizidine alkaloids in honey and bee pollen[J].Food Additive Contaminants:Part A,2011,28(3):348-358.
[13]程莉,王丹,周爽,等.超高效液相相色谱-三重四极杆串联质谱法测定蜂蜜中吡咯里西啶类生物碱[J].环境化学,2014,33(11):1971-1977.
[14]杜凤君,徐敦明,张志刚,等.QuEChERS-高效液相色谱-串联质谱法同时分析蜂蜜中33种生物碱[J].分析科学学报,2019,35(6):817-823.
[15]毛思浩,刘柱,梁晶晶,等.全自动固相萃取-超高效液相色谱-串联质谱法测定蜂蜜中硝基呋喃类代谢物[J].分析科学学报,2020,36(4):572-578.
[16]林麒,罗赟,华永有,等.全自动固相萃取-高效液相色谱-串联质谱法测定水中16种喹诺酮类抗生素[J].现代预防医学,2018,45(2):335-339.
[17]朱群英,朱玉玲,索莉莉,等.在线固相萃取-高效液相色谱法同时测定豆芽中11种植物生长剂和杀菌剂[J].分析科学学报,2018,34(4):507-512.
[18]曾三妹,徐敦明,魏一婷,等.全自动固相萃取-高效液相色谱-串联质谱法测定食糖中的雌二醇[J].色谱,2016,34(7):
703-707.
[19]徐潇颖,赵超群,梁晶晶,等.全自动固相萃取-高效液相色谱-串联质谱法测定豆芽中15种喹诺酮类药物的残留量[J].理化检验(化学分册),2020,56(5):583-589.

相关热词搜索:
[责任编辑:]

 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《食品安全导刊》杂志订阅返百元红包!
2019《食品安全导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 食安中国网关于2015年春节放假的通知
食安中国网关于2015年春节放假的通知
 食品安全新动向讲座:权威解读食品安全中的过敏原问
食品安全新动向讲座:权威解读食品安全中的过敏原问
 【采访ADM】力行不辍、多元发展,满足消费者的营养
【采访ADM】力行不辍、多元发展,满足消费者的营养
 食品掺假与成分检测网络研讨会
食品掺假与成分检测网络研讨会
 权威专家解读食品中的丙烯酰胺及含量控制措施,快来
权威专家解读食品中的丙烯酰胺及含量控制措施,快来
 专家齐聚第三届全球食品安全共治论坛,启动食品安全
专家齐聚第三届全球食品安全共治论坛,启动食品安全






参与评论