超高效液相色谱-串联质谱法测定鸡肉中羟基甲硝唑和羟甲基甲硝咪
超高效液相色谱-串联质谱法测定鸡肉中羟基甲硝唑和羟甲基甲硝咪唑残留量
□ 李垚辛 南充市食品药品检验所
摘 要:本文建立了高效液相色谱-串联质谱法检测鸡肉中两种硝基咪唑代谢产物——羟基甲硝唑和羟甲基甲硝咪唑的分析方法。样品经乙腈提取,正己烷除脂,Retain-CX固相萃取柱净化,以0.1%甲酸水溶液和乙腈作为流动相梯度洗脱,C18色谱柱分离,正离子模式电喷雾电离,多反应监测(MRM)测定鸡肉中羟基甲硝唑和羟甲基甲硝咪唑含量。在5.0~200ng/mL范围内,两种代谢物的线性关系良好,相关系数(r2)大于0.997,检出限为0.13~0.16μg/kg,定量限为0.43~0.53μg/kg,在1.0μg/kg、5.0μg/kg、10μg/kg这3个加标浓度下的回收率为76.0%~109.8%,相对标准偏差为2.7%~14.5%(n=6)。这说明,该方法准确、高效,适用于鸡肉中羟基甲硝唑和羟甲基甲硝咪唑的检测。
关键词:鸡肉 液相色谱-串联质谱法 固相萃取 羟基甲硝唑 羟甲基甲硝咪唑
1 引言
硝基咪唑类药物是一类应用广泛的人工合成的具有5-硝基咪唑基本结构的化合物,常用药物主要有甲硝唑、地美硝唑和洛硝哒唑等。此类药物能杀灭和预防厌氧菌及病原虫,可用于治疗与预防家禽的滴虫病、球虫病、猪密螺旋体性痢疾及动物的各种厌氧菌感染[1]。由于硝基咪唑类药物含有的硝基杂环类化合物存在细胞诱变性,因此具有潜在的动物致癌、致畸、致突变作用和遗传毒性,其药物残留对动物源性食品安全构成了直接威胁,故被许多国家列为违禁药物[2]。我国农业部235号公告明确规定,甲硝唑和地美硝唑允许用作治疗药物,但不得在动物性食品中检出;洛硝达唑禁止使用且不得在动物性食品中检出[3]。羟基甲硝唑(MNZOH)是甲硝唑(Metronidazole)的代谢产物,羟甲基甲硝咪唑(HMMNI)是地美硝唑(Dimetridazole)和洛硝达唑(Ronidazole)的代谢产物。建立以上两种硝基咪唑代谢物的分析方法对于防控动物源性食品安全风险,监测硝基咪唑类药物使用及残留情况具有重要意义。
目前,关于硝基咪唑类药物的检测方法主要有酶联免疫法[4]、高效液相色谱法[5-6]、气相色谱法[7]、气相色谱-质谱法[8]、液相色谱-质谱或串联质谱联用法[9-12]等。虽然我国制定了一些相关的检测标准[14-16],但大部分方法的检测限相对较高,且主要针对硝基咪唑类原药,对于其代谢物的检测研究较少。本文采用超高效液相色谱-串联质谱法(UPLC-MS/MS),分别对液相条件和质谱条件进行了优化,建立了鸡肉中羟基甲硝唑、羟甲基甲硝咪唑的检测方法,以期为实验室日常检测和监管硝基咪唑类药物在食品中的滥用提供技术支持。
2 材料与方法
2.1 仪器与试剂
仪器:Agilent 1290液相色谱、6420三重串联四极杆质谱联用仪,美国Agilent公司;ML203/02分析天平(0.001g),上海Mettler Toledo公司;XS205DU分析天平(0.01mg),上海Mettler Toledo公司;固相萃取小柱(HYPERSEP RETAIN-CX,60mg/3mL),美国Thermo公司;均质机,中国睿科公司;离心机,德国Eppendorf公司。
试剂:甲醇、乙腈、正己烷、甲酸、乙酸铵(色谱纯),美国Thermo公司;羟基甲硝唑标准品,德国Dr公司;羟甲基甲硝咪唑标准品,德国WITEGA公司;实验室用水为Milli-Q超纯水。
产品:市售鸡肉。
2.2 实验方法
2.2.1 样品前处理
称取均质试样5g(精确到0.01g)置于50mL离心管中,加入5mL饱和氯化钠溶液和15mL乙腈,均质提取1min,4000r/min离心5min。然后,将上清液转移至100mL鸡心瓶中,再用15mL乙腈重复提取残渣两次。合并上清液至同一鸡心瓶中,40℃旋转蒸发至近干,加入5mL0.1%甲酸水溶液和5mL正己烷,混匀离心后,弃去正己烷层,待净化。
Retain-CX固相萃取柱使用前依次用3mL甲醇、3mL水、3mL0.1%甲酸水活化,将待净化液以1~2mL/min的速度过柱,用3mL0.1%甲酸水、3mL甲醇淋洗小柱,最后用3mL5%氨水甲醇分两次洗脱,收集洗脱液于40℃氮气下吹干,用1mL初始流动相溶解残渣,过0.22μm滤膜,待上机。
2.2.2 标准溶液的配制
称取羟基甲硝唑和羟甲基甲硝咪唑标准品,用甲醇稀释成1μg/mL的混合标准工作液。称取6份空白样品,按最终定容浓度5ng/mL、10ng/mL、20ng/mL、50ng/mL、100ng/mL、200ng/mL分别加入混合标准工作液,余下按样品处理步骤制备基质加标标准系列。
2.2.3 仪器条件
2.2.3.1 液相条件
安捷伦ZORBAX Eclipse Plus C18色谱柱(2.1mm×100mm,1.8μm);0.1%甲酸水溶液为流动相A,乙腈为流动相B;流速:0.3mL/min;进样体积:10μL;柱温:40℃;洗脱程序:30%B(0~0.5min),30%~90%B(0.5~3min),90%B(3~7min)。
2.2.3.2 质谱条件
离子源:ESI+;检测方式:多反应监测(MRM);干燥气温度:300℃;干燥气流量:10L/min;雾化气压力:40psi;毛细管电压:4000V;目标物质谱参数见表1。
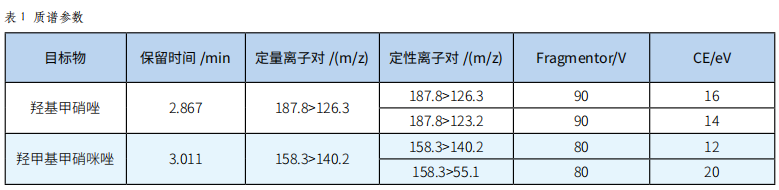
3 结果与分析
3.1 线性范围、检出限和定量限
将基质加标标准系列注入液相色谱-质谱联用仪中,以质量浓度为横坐标X,以峰面积为纵坐标Y建立线性回归方程,结果表明,羟基甲硝唑和羟甲基甲硝咪唑浓度在5~100ng/mL范围内线性关系良好,相关系数(r2)均大于0.997。
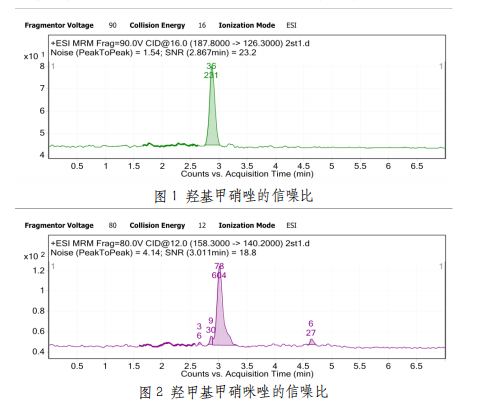
用标准系列第1点测得信噪比,结果见图1、图2。以信噪比(S/N)=3时的含量定为方法的检出限(LOD),以信噪比(S/N)=10时的含量定为方法的定量下限(LOQ),结果见表2。

3.2 回收率与精密度
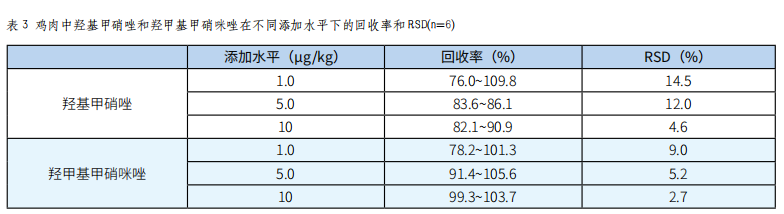
称取空白样品,添加混合标准溶液,添加水平为1.0μg/kg、5.0μg/kg、10μg/kg,每个水平做6个平行,得到回收率和精密度,结果见表3。羟基甲硝唑的回收率为76.0%~109.8%,相对标准偏差(RSD)为4.6%~14.5%;羟甲基甲硝咪唑的回收率为78.2%~105.6%,相对标准偏差(RSD)为2.7%~9.0%。
3.3 实际样品分析
采购了不同地点的10份市售鸡肉样品进行检测,均未检出羟基甲硝唑和羟甲基甲硝咪唑这两种硝基咪唑类代谢物。
4 结论
本文采用乙腈提取,正己烷脱脂,固相萃取柱净化,超高效液相色谱-串联质谱检测,建立了鸡肉中羟基甲硝唑和羟甲基甲硝咪唑残留的分析方法。该方法操作简便,准确性好,灵敏度高,适用于实验室日常检测,也为硝基咪唑类药物监测提供了技术支撑。
参考文献:
[1] 魏云计,朱臻怡,冯民,何健,沈金荣,何正和,秦娴,张伶俐,钱怡平,丁涛等.高效液相色谱-串联质谱快速测定饲料中硝基咪唑类药物及其代谢物残留[J].分析测试学报.
[2] 丁燕玲,陈彤,黄婷,等.超高效液相色谱-串联质谱法测定鸡肉中甲硝唑、二甲硝唑及其代谢物的方法研究[J].广东化工,2018,45(13):245-24.8.
[3] 中华人民共和国农业部第235号公告,2002.
[4] 张弛,潘家荣,帅瑞琪,方豪,冯依.动物性食品中硝基咪唑类兽药多残留酶联免疫检测方法的建立[J].核农学报,2016,30(2):0323-0331.
[5] 王扬,郑重莺,何丰,叶磊海.高效液相色谱法测定罗非鱼肌肉中硝基咪唑类多组分残留量[J].食品科学2011,32(20).
[6] 于敏,张美娟,张河霞,乌恩其木格,王丹慧,武慧明,秦培林,高效液相色谱法测定牛奶中硝基咪唑类残留量[J].食品安全质量测学报,2018,9(2),447-451.
[7] 刘波,黄为红,王金中.气相色谱一电子捕获检测器同时检测硝基咪唑类药物[J].分析科学学报,2008,24(5):586–588.
[8] 汪纪仓,马素英,王大菊,等.气相色谱一离子阱串联质谱法同时测定猪肌肉中硝基咪唑类药物残留[J].畜牧兽医学报,2008,39(12):1772–1778.
[9] 方力,邱凤梅,余新威,张志超.基质分散固相萃取-液相色谱-串联质谱法检测动物源性食品中硝基咪唑药物及其代谢物[J].色谱,2018,36,(5):431-438.
[10] 黎翠玉,吴敏,严丽娟,曾三妹,徐敦明,周昱.高效液相色谱-串联质谱测定动物源性食品中硝基咪唑类药物及其代谢物残留量[J].食品安全质量检测学报2012,3(1):17-22.
[11] 高海荣.二氧化锆QuEChERS-高效液相色谱-串联质谱测定鱼肉中2种硝基咪唑及代谢产物[J].食品工业科技,2019,40(4):266-270.
[12] 励炯,孙岚,王红青,邱红钰,康健.分散固相萃取净化/高效液相色谱-串联质谱法测定水产品中的5种硝基咪唑类药物残留[J].分析测试学报,2017,36(11):1357-1362.
[13] 中华人民共和国国家质量监督检验检疫总局.GB/T 21318-2007动物源性食品中硝基咪唑类残留量检测方法[S]北京:中国标准出版社,2007.
[14] SN/T 1928-2007 进出口动物源性食品中硝基咪唑残留量检测方法 液相色谱-质谱/质谱法[S],2007.
[15] GB/T 21318-2007 动物源性食品中硝基咪唑残留量检验方法[S],2007.
[16] 农业部1025号公告-22-2008 动物源食品中4种硝基咪唑残留检测 液相色谱-串联质谱法[S],2008.

相关热词搜索:
[责任编辑:]

 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 2019《食品安全导刊》杂志订阅返百元红包!
2019《食品安全导刊》杂志订阅返百元红包!
 9月大事 | 市场监管总局开展2018年全国“质量月”活动
9月大事 | 市场监管总局开展2018年全国“质量月”活动
 盒装水果省事不卫生 实验解释3大疑问
盒装水果省事不卫生 实验解释3大疑问
 “食安中国网”手机站上线通知
“食安中国网”手机站上线通知
 食安中国网关于2015年春节放假的通知
食安中国网关于2015年春节放假的通知
 企业交流学习的桥梁 食品人技能提升的平台
企业交流学习的桥梁 食品人技能提升的平台
 探讨食品安全未来趋势 引领食品安全技术发展
探讨食品安全未来趋势 引领食品安全技术发展
 CAC (China) HACCP内审员
CAC (China) HACCP内审员
 2019《食品安全导刊》杂志订阅返百元红包!
2019《食品安全导刊》杂志订阅返百元红包!
 食品企业收到《行政处罚决定书》后应如何处理?
食品企业收到《行政处罚决定书》后应如何处理?





参与评论