浅谈美国医用食品(Medical Foods)的监管法规与市场准入
□ 陶鑫 霍金路伟律师事务所华盛顿办公室
特殊医学用途配方食品(简称“特医食品”)是指为满足进食受限、消化吸收障碍、代谢紊乱或特定疾病状态人群对营养或膳食的特殊需求,专门加工配制而成的配方食品。2016年《特殊医学用途配方食品注册管理办法》的实施标志着我国特殊医学用途配方食品市场正式开放;2017年4月,原国家食品药品监督管理总局成立了特殊食品注册管理司;截至2018年10月,累计共有18款特医食品获得国家市场监督管理总局的相关批文。
在美国,特殊医学用途配方食品又被称为“医用食品”(Medical Foods),并于1988年修订的《孤儿药法案》(Orphan Drug Act,也称“罕见病药物法案”)中首次被明确定义。经过多年的发展,医用食品市场在美国已十分成熟。本文浅谈美国医用食品的监管与市场准入的相关法规,以期对国内特医食品厂商的前瞻性布局有所启示。
美国医用食品的定义
美国于1988年修订的《孤儿药法案》将医用食品定义为“为满足疾病或特殊状态下特定的营养需求,且基于公认的科学原则并建立在医学评估基础上的主要用于口服的配方食物,其使用需要在医生的监护下进行。”美国食品药品监督管理局(FDA)是医用食品的主要监管机构,其对何种食品能够被认定为医用食品持审慎态度。FDA在给业界的指南文件中反复强调,医用食品并非包括所有医生推荐给病人帮助其缓解病症或补充特定营养的食品。为了帮助业界更好的理解医用食品的定义,美国食品药品监督管理局在21CFR§101.9中对医用食品的概念作了包含5个要素的更详细的陈述。
①医用食品必须是特别配制加工的食品(区别于天然食品或食物的自然状态),主要通过口服的方式为病人提供全部或部分营养;
②医用食品是补充病人因治疗或慢性疾病的需要,对普通食品或特定营养素在消化、吸收或代谢功能上受限或受损,或因其他特殊的医学确定的营养管理要求,同时该营养要求通过普通食品又无法得到补充;
③经过医学评估,医用食品对某些疾病或特殊状态有特定的营养支持效果;
④医用食品必须在医生指导下使用;
⑤医用食品只能提供给正在接受治疗和医学看护的需要医疗服务的病人。
如果把以上陈述与1988年《孤儿药法案》中的法律定义作比较会发现,FDA通过21 CFR§101.9实质上对医用食品的定义增加了更多的限制。按照FDA的定义,有些食品尽管可能符合法律定义,但仍被排除在医用食品以外。例如,FDA认为怀孕女性的营养需求与常人不同,且一些饮食不能满足怀孕期女性的独特营养需求,但是医用食品的概念仍不适用于孕期人群,这是因为怀孕女性可以按照FDA提供的营养建议来改变正常的饮食习惯去获取所需营养。换言之,如果可以通过普通食品获得特定的所需营养,则医用食品的定义不适用,这是FDA利用以上陈述中的第二个要素对医用食品设置的一大限制。
美国医用食品的特性和市场准入
尽管医用食品为病人使用,但从监管层级来讲其为食品而非药品。食品与药品最大的不同在于使用意向:一般来讲,食品的标示和广告宣传中不能提及或关联任何疾病;医用食品与普通食品的不同就在于其能够标注与疾病有关的营养学声称。美国市场上的医用食品主要分为四类:全营养配方、非全营养配方、用于12个月以上代谢异常病人的配方食品和口服的补水产品。用于医用食品的成分应符合4点条件:符合FDA在21 CFR part 172中的食品添加剂法规;色素成分符合 21 CFR parts 73 and 74中的相关色素使用法规;经过科学程序的专家评审,被认为是公认安全(GRAS);曾经另外通过专门审批。
虽然满足以上监管要求的医用食品很多,且大多数不需要通过FDA上市前的审批,但是企业需要特别注意,医用食品的配方中所含营养成分必须能够满足关联的疾病或特殊情况的特定营养需求——这往往要求企业拥有使用该医用食品的临床试验数据或相关的医学文献作为证据,因为任何对于医用食品营养效用的宣传必须真实有效。
医用食品的生产还需遵守食品生产的现行良好生产规范(cGMP)。按照美国现行的针对医用食品的合规计划《医用食品方案-进口及国产》,FDA会对医用食品生产企业进行年度的现场检查。对于企业显著违反美国食品药品相关法律法规的情况,FDA会在“483”表中作为观察项提出并给出整改建议。
近年美国医用食品的监管热点
近年来,FDA对医用食品的监管侧重于产品是否符合医用食品的定义。如前文所述,FDA对医用食品在法律定义的基础上额外添加了很多限制,其在对企业进行监管执法中引用最多的一条是所谓的特殊营养需求。在FDA近年给业界发出的警告信(Warning Letter)中,这一条被反复提及。
①FDA给NVN Therapeutics的警告信
“尽管部分患者通过饮食获得绿原酸和L-半胱氨酸能够带来益处,但多囊卵巢综合征(PCOS)患者在饮食中没有确定的特殊营养需求。”
②FDA给Realm Labs,LLC的警告信
“虽然您的产品标签表明NeuRemedy产品所针对的患者含有低水平的微量营养素硫胺素,但FDA并未发现有任何证据表明患有神经病变的患者摄取、消化、吸收或代谢硫胺素的能力有限或受损,或对硫胺素有确定的特殊营养需求。”
值得一提的是,FDA从未对所谓的特殊营养需求作出任何定义,当前所确定符合FDA特殊营养需求的例子仅包括患有遗传的代谢异常的病人(比如苯丙酮尿症)。尽管市场上针对各类疾病的医用食品很多,但FDA并未对何种疾病可以应用医用食品做出明确描述。这一方面赋予了业界弹性来开发更多的有益产品,另一方面也带来了监管的不确定性和潜在风险。
结 语
据市场调查估计,2015年美国的医用食品市值为13亿美金,并以每年6.5%的速度增长。美国医用食品近年来的迅猛发展,除了得益于其人口老龄化和老年病的流行,也依托于相对宽松的监管环境。虽然市场准入不设门槛,但FDA对企业是否拥有产品可以满足病人特殊营养需求的临床数据十分看重,这对我国的特医食品生产企业来说是个不小的挑战,更是不可多得的机遇。


相关热词搜索:
[责任编辑:]

 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
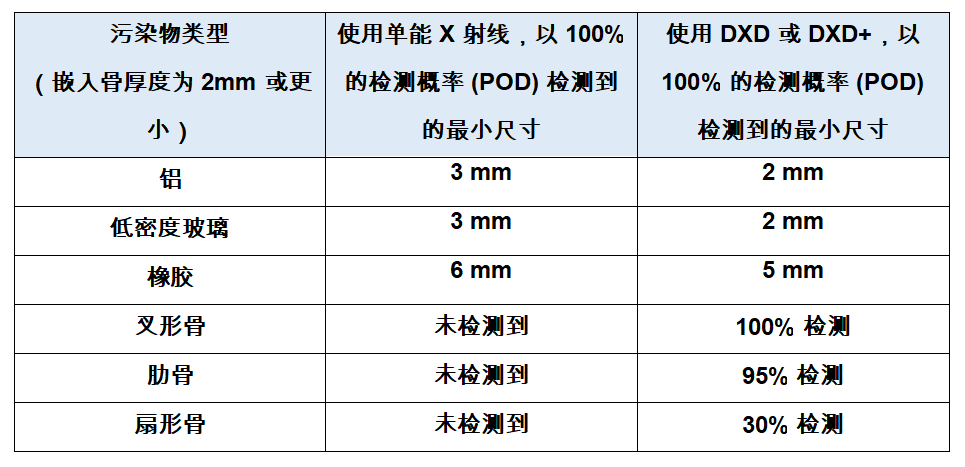 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论