臭豆腐和腐乳中生物胺的调查研究
本文采用RP-HPLC法测定了臭豆腐和腐乳中的生物胺(色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺)的含量。样品经0.4 mol·L-1液提取, 丹磺酰氯衍生, 流动相为乙腈和水,采用梯度洗脱,流速为1mL·min-1,紫外检测波长为254 nm。结果表明臭豆腐和腐乳中生物胺的种类及含量因臭豆腐和腐乳的品种而异,臭豆腐中8种生物胺总量平均为6.825 mg·100g-1,腐乳中8种生物胺总量平均为134.383 mg·100g-1。本法用于臭豆腐和腐乳的测定具有简便、快速、灵敏、可靠的优点。
Reserch of Biogenic Amines in Stinkytofu and Sufu
Abstract:The biogenic amines content such as tryptamine,phenylethylamine, putrescine, cadaverine , histamine, tyramine, spermidine and spermine in Stinkytofu and Sufu were evaluated simultaneity by RP-HPLC in this paper. Samples were extracted by 0.4mol·L-1 HClO4, and then derived using Dns-Cl. The mobile phase was a gradient elution program with a binary mixture of a cetonitrile and water. The flow rate was 1 mL·min-1. Waters 2487 Dual λ Absorbance detector was used in the final determination with λ =254 nm. It was noticed that the biogenic amine kinds an contents varied with different Stinkytofu and Sufu. The average of total biogenic amine in Stinkytofu was 6.825 mg·100g-1, the average of total biogenic amine in Sufu was 134.383 mg·100g-1.This method of Stinkytofu and Sufu was simple and convenient to work, the result was sensitive to be given rapidly and dependably.
引言 臭豆腐根据工艺不同分为非发酵和发酵两种。油炸臭豆腐属于非发酵臭豆腐,而发酵的臭豆腐是腐乳的一种,学名青方腐乳[1] 。臭豆腐种类繁多,主要有长沙火宫殿臭干子、王致和臭豆腐、湖北臭豆腐、安徽臭豆腐、浙江臭豆腐、江苏臭豆腐、江西臭豆腐、 贵州臭豆腐、云南臭豆腐等[2] 。腐乳通常分为青方、红方、白方三大类。其中,臭豆腐属‘青方’;‘大块’、‘红辣’、‘玫瑰’等酱腐乳属‘红方’;‘甜辣’、‘桂花’、‘五香’等属‘白方’。青方是指臭腐乳,又称青色腐乳,它是在腌制过程中加入了苦浆水、盐水,故呈豆青色;红方是腐乳坯加红曲色素即为红腐乳;白方是在生产时不加红曲色素,使其保持本色。腐乳品种中还有添加糟米的称为糟方,添加黄酒的称为醉方,以及添加芝麻、玫瑰、虾籽、香油等的花色腐乳。臭豆腐和腐乳具有营养价值高、易消化、室温保存、食用方便等特点,深受消费者的喜爱。
目前臭豆腐和腐乳的安全卫生问题突出。臭豆腐的生产工序是在自然条件下进行的,易被微生物污染,造成安全问题。食用自制臭豆腐发生肉毒杆菌中毒的事亦有报道 [3] 。据测定,平均每1kg臭豆腐含有4.9 g挥发性盐基氮、16.5 mg 硫化氢。它们具有一股特殊的臭味和很强的挥发性,多吃对健康无益。存放时间长了,胺类可能与亚硝酸盐作用,生成强致癌物亚硝胺。甚至有生产者竟在臭豆腐中加入非食品添加剂——工业硫酸亚铁[4] 。工业硫酸亚铁被加入后,可与发酵物作用产生墨黑色的硫化铁,能使普通香干、豆腐迅速变色上味。一旦食用,会引起牙齿变黑、腹痛、恶心、呕吐,严重者还会导致肺积水、肝变性、休克等症状。腐乳的生产采用的是固态发酵技术,不像现代深层液体发酵那样对发酵底物进行严格的灭菌,其发酵过程也是开放式的,因此腐乳作为一种高蛋白食品,其感染病原微生物的机率相当大[5] 。多食或长期大量食用腐乳,可引起胃肠道疾病或诱发癌症。而且服用四环素类药物及红霉素、灭滴灵、甲氰咪胍时食有腐乳,可使药效减弱。此外,久食腐乳,可使老年人的组织器官日益衰退,各部分的功能相对减弱和降低。同时,可因摄钠过多诱发心血管系统及肝、肾等组织器官病变。
作为臭豆腐和腐乳安全性问题之一的生物胺引起了我们实验组的注意。生物胺(biogenic amines,BA)是指一类含氮的脂肪族、芳香族或杂环类有机化合物[6] 。它是一种低分子量的有机物,主要通过氨基酸的脱羧作用生成。适量的生物胺在人和动物的活性细胞中发挥着重要的生理作用,如促进生长、增强代谢活力、加强肠道免疫系统、并在神经系统中有活性、控制血压,在消除自由基方面也有一定的作用[7,8] 等等。但是当生物胺在人体体内积累到一定数量时,就会产生毒害作用,如外部血管膨胀、导致高血压和头痛、以及肠道平滑肌的收缩、造成腹部痉挛、呕吐和腹泻等[9] ,人们熟悉的亚硝胺就具有极强的致癌作用。组胺和多胺可与H2受体作用或促进血管生成而直接导致细胞转化和肿瘤。
生物胺分析方法包括比色法、氨基酸分析法、毛细管区带电泳法和色谱法。随着高效液相色谱及填料的发展, HPLC在生物胺检测方面显示了其特有的优越性。但大多数生物胺无紫外吸收和荧光发射特性, 为提高分析检测灵敏度和分离选择性, 通常将生物胺衍生, 衍生方式有柱前衍生法[10]和柱后衍生法[11]。本文采用丹酰氯柱前衍生HPLC法同时测定了市场上的8种臭豆腐和10种腐乳中色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺的含量,并绘制了这8种生物胺的标准曲线,同时对结果进行了比较,希望能够为国内食品行业中臭豆腐和腐乳中生物胺的检测研究提供有益参考。
1 材料与方法
1.1 材料
1.1.1 试剂
色胺(TRY)、苯乙胺(PHE)、腐胺(PUT)、尸胺(CAD)、组胺(HIS)、酪胺(TYR)、亚精胺(SPD)、精胺(SPM) 、丹酰氯, 均购自Sigma公司;乙腈、丙酮, 均为HPLC级;超纯水(南京总馨纯水设备公司生产的型号为MDL9000(B)-H-30型台式实验室超纯水系统制得), 其他试剂均为分析纯。
臭豆腐和腐乳:购于南京市场。
生物胺标准储备液: 准确称取适量生物胺标准品, 用0.4 mol·L-1高氯酸(HClO4)分别配制成1 mg·mL-1的标准储备液, 铝箔避光、4 ℃保存, 根据需要用0.4 mol·L-1高氯酸将储备液稀释到适当的中间浓度。
丹酰氯衍生剂:准确称取丹酰氯500 mg至50 mL棕色容量瓶中,用10 mg·mL-1丙酮溶解并定容。
1.1.2 主要仪器与设备
Waters液相色谱系统(柱温箱、Empower p ro色谱软件); Waters Alliance 2695 Separations Module, Waters 2487 Dual λ Absorbance Detector, AgilentZORBAX XDB-C18 (4.6×250mm2, 5μm)
1.2 方法
1.2.1样品处理
1.2.1.1标准样品
准确称取色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺各50 mg,用0.4 mol·L-1的高氯酸(HClO4)定容至50 mL,并分别稀释制成终浓度分别为:0.5、1.0、2.0、5.0、10、20 μg·mL-1的混合标准溶液。取1mL的标准品混合溶液,加入200μL 2 mol·L-1 NaOH使之呈碱性,再加入300 μL饱和NaHCO3溶液进行缓冲,然后再加入2 mL丹磺酰氯(dansyl chloride)溶液(10 mg·mL-1溶于丙酮),丹磺酰氯溶液在室温下处于黑暗中反应处理。30 min后加入100 μLNH4OH中止反应。加入乙腈使终体积为5 mL。衍生处理后0.45 μm滤膜过滤,用于分析检测。
检测结果以标准品浓度为横坐标,峰面积为纵坐标绘制标准曲线。
1.2.1.2 样品
分别准确称取5 g臭豆腐,剪碎加入20 mL的0.4 mol·L-1的高氯酸(HClO4),匀浆机上彻底匀浆,冷冻离心机4℃、2500 rpm离心10 min,取上清液;沉淀部分如前方法再重新提取。取二次的上清液用0.4 mol·L-1的高氯酸稀释到50 mL。取1 mL样液同标准溶液进行柱前衍生。
腐乳样品制法同上。
1.2.2 色谱条件
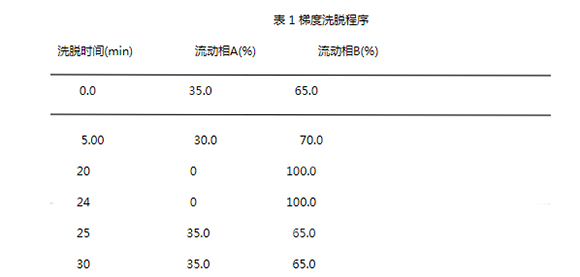
柱温:30℃;流速:1.0 mL·min-1;进样量:20 uL;检测波长:254 nm;流动相:水(A溶液)和乙腈acetonitrile(B溶液),按下面的梯度运行。
2 结果与分析
2.2 臭豆腐和腐乳中生物胺的种类及含量
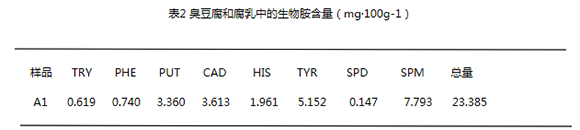
利用本文建立的方法对不同种类的臭豆腐和腐乳中的8种生物胺含量进行测定,结果见表2。

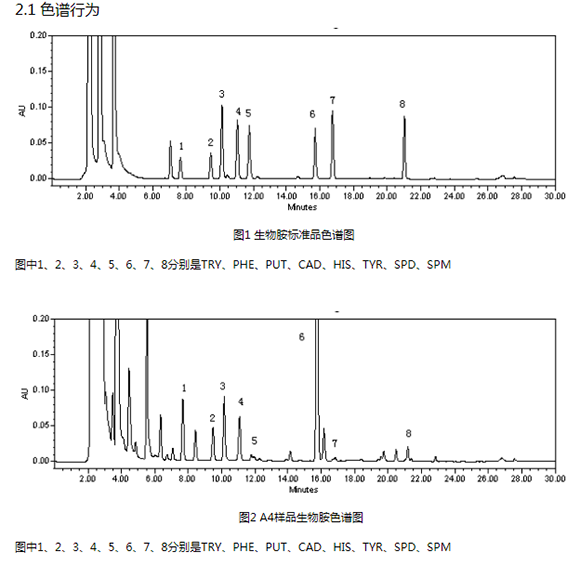
实验采用乙睛和水为流动相,以表1所示的梯度程序洗脱。标准品和样品结果均表明8种组分能有效分离,且峰形对称,没有拖尾等现象(见图1和图2)。此外,使用该流动相可在前5 min内流出全部溶剂峰及其他杂质峰,25 min左右试样中生物胺可被全部洗脱。
由图1与图2的对比分析可见,标准品色谱图中,色胺、苯乙胺的吸收峰较低,其余6种生物胺的吸收峰相差不大,且以腐胺的吸收峰为最高。A4样品生物胺色谱图中,色胺、苯乙胺和酪胺的吸收峰较标准品都较高,其中酪胺的吸收峰为8种生物胺中最高。
由表2可见,不同公司生产的腐乳生物胺含量有明显的差异,其中以M公司生产的A3腐乳样品生物胺总量最少,X公司生产的A8腐乳样品生物胺含量最高。A3腐乳样品的生物胺总量仅为13.614 mg·100g-1,A8腐乳样品的生物胺总量为336.696 mg·100g-1。我们认为,这可能与不同公司生产腐乳的生产地区、原料、加工工艺及贮藏方式等的不同有关。但是即使是同一家公司生产的腐乳生物胺含量也有明显的差异,如N公司生产的A5腐乳样品与A6腐乳样品比较,A5腐乳样品的生物胺总量仅为16.603 mg·100g-1,A6腐乳样品的生物胺总量为326.389 mg·100g-1。这可能与不同腐乳样品中添加的调味料的不同有关。与腐乳相比,臭豆腐中生物胺的含量则明显少得多,A11臭豆腐样品中的生物胺含量最高,亦仅有23.897 mg·100g-1。由此可见,臭豆腐和腐乳中生物胺的种类与含量的差别很可能与其加工工艺的不同有关。因为腐乳中的生物胺含量明显比臭豆腐中的生物胺含量多得多,而生物胺主要通过氨基酸的脱羧作用生成,由此我们可以认为,氨基酸的脱羧作用主要发生在发酵过程中。
3 讨 论
生物胺中腐胺、尸胺、组胺、酪胺因为具有一定的毒性,是与食品的卫生安全最相关的,故我们主要对臭豆腐和腐乳中的这四种胺进行了分析。腐乳样品中A6、A8、A9腐乳样品中的腐胺含量偏高,其中A6腐乳样品是N公司产品,A8、A9腐乳样品是X公司产品;腐乳样品中A2、A6、A9、A10腐乳样品中的尸胺含量偏高,其中A2腐乳样品是M公司产品,A6腐乳样品是N公司产品,A9腐乳样品是X公司产品,A10腐乳样品是Y公司产品;腐乳样品中A2、A6、A8、A9腐乳样品中的组胺含量偏高,其中A2腐乳样品是M公司产品,A6腐乳样品是N公司产品,A8、A9腐乳样品是X公司产品;腐乳样品中A4、A6、A8、A9腐乳样品中的酪胺含量偏高,其中A4腐乳样品是M公司产品,A6腐乳样品是N公司产品,A8、A9腐乳样品是X公司产品。这可能与生产地区、原料、调味料、加工工艺及贮藏方式等的不同有关。臭豆腐样品中A11、A13样品中的腐胺含量偏高,A11、A12样品中的尸胺含量偏高,A11样品中的酪胺含量偏高。这可能与原料、加工工艺及贮藏方式等的不同有关。
大量研究表明,组胺是对人体最有害的一种,而酪胺在量上是最重要的,并且其它生物胺的存在可能加强酪胺对人类健康的副作用。摄入 8~40mg 组胺产生轻微中毒症状,超过 40mg产生中等中毒症状,超过 100mg 产生严重中毒症状。酪胺超过 l00mg会引起偏头痛。所以,通常被看作生物胺中最重要的两类,并以这两种生物胺作为测定指标。欧盟、美国都对部分食品中组胺含量做了限量要求:美国FDA根据对爆发组胺中毒的大量数据研究结果确定组胺的危害作用水平为500 mg·kg-1,同时要求进口水产品组胺不得超过50 mg·kg-1;欧盟规定鲭科鱼类中组胺含量不得超100 mg·kg-1,其他食品中组胺不得超过100 mg·kg-1,酪胺不得超过100~800 mg·kg-1。我国规定鲐鱼中组胺不得超过1000 mg·kg-1,其他海水鱼不得超过300 mg·kg-1 [12]。
臭豆腐中组胺平均含量为0.273 mg·100g-1,最大值为0.526 mg·100g-1;腐乳中组胺平均含量为11.801 mg·100g-1,最大值为42.949 mg·100g-1。臭豆腐中酪胺平均含量为0.371 mg·100g-1,最大值为2.211 mg·100g-1;腐乳中酪胺平均含量为45.876 mg·100g-1,最大值为133.121 mg·100g-1。臭豆腐和腐乳中组胺含量均未超标,但腐乳中的组胺含量远远超出臭豆腐中的组胺含量。臭豆腐中酪胺含量未超标,但是腐乳中酪胺含量则远远超出标准。故本次实验所用的腐乳样品就酪胺含量而言,一半是不及格,没有达到卫生标准的。
不同小吃摊点的臭豆腐生物胺含量相差并不大,而不同的腐乳生物胺含量各异,这说明虽然臭豆腐等非发酵食品本身含有低浓度的生物胺,但食品中生物胺主要还是由氨基酸经乳酸菌脱羧形成,而且高浓度的生物胺往往出现在发酵食品中,因为发酵食品更容易污染具有高活性氨基酸脱羧酶的微生物。(周 薇)
参考文献:
[1] 吴彩梅, 王静, 曹维强. 臭豆腐的不安全因素及其监控[J]. 食品与发酵工业, 2005, (07):
97-99
[2] 王翁如. 关于臭豆腐[J]. 食品与健康, 1994, (06):31
[3] 沈慧. 吃自制臭豆腐谨防中毒[J] . 医药与保健, 2006, (10): 45
[4] 杨明. 臭豆腐最好少吃[J] . 小康生活, 2006, (02): 56
[5] 李理, 罗立新, 梁世中. 腐乳的研究进展[J] . 食品与发酵工业, 2002, (10): 70-74
[6] 吴延东. 啤酒中生物胺的产生与控制[J].淮阴工学院学报,2003,12(5): 86-88.
[7] Hala′ sz, A., Bara′ th, A., Simon-Sarkadi, L., et al. (1994). Biogenic amines and their production by
microorganisms in food.Trends in Food Science & Technology, 5, 42–49
[8] Lima, A. S., & Glo′ ria, M. B. A. (1999). Aminas bioativas em alimentos.Bol. SBCTA, 33, (1): 70–79
[9] Silla-Santos.M.H. Biogenic amines:here importance in foods[J]. International Journal of Food
Microbiology, 1996, (29): 213-231
[10] Jochen K, Kerstin R, Hansb. Liquid chromatographic determination of biogenic amines in fermented foods after derivatization with 3, 5-dinitrobenzoyl chloride[J]. J Chromatogr A, 2000, (881): 517 - 530
[11] Koichis, Masakazuh, Norihiden. High performance liquid chromatography of histamine and 1-methylhistamine with on-column fluorescence derivatization [J]. J Chromatogr, 1992, (595): 163 – 168
[12] 李志军. 生物胺与食品安全[J]. 食品与发酵工业, 2004, 7
[13] 李志军. 生物胺与食品安全[J]. 食品与发酵工业, 2004, 30(10):84-91
[14] Santos C,Marin A,Rivas J C. Changes of tyramine during storage and spoilage of anchovies[J]. J
Food Sci,1986,51 (3):512~513:515
[15] Pogorzelski E. Studies on the formation of histamine in must and wines from clderberry fruit[J]. J Sci
A-gric,1992,60 (2):239~243
[16] Baranowski J D,Brust P A,Frank H A. Growth of Klebsiella pneumoniae UH~ 2 and properties of its
histidine decarboxylase system in resting cells[J]. J Food Biochem,1985,9 (2) :349~360
[17] Shalaby A R. Significance of biogenic amines to food safety and human health[J]. Food Research International,1996,29 (7):675~690
[18] Claudia R C, Antonio M. Effect of controlled atmo-spheres enriched with O2in formation of biogenic
amines in chilled hake( Merluccius merluccius L.)[J]. Eur Food Res Technol,2001,212 (3):546~550

[责任编辑:吴森林]

 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
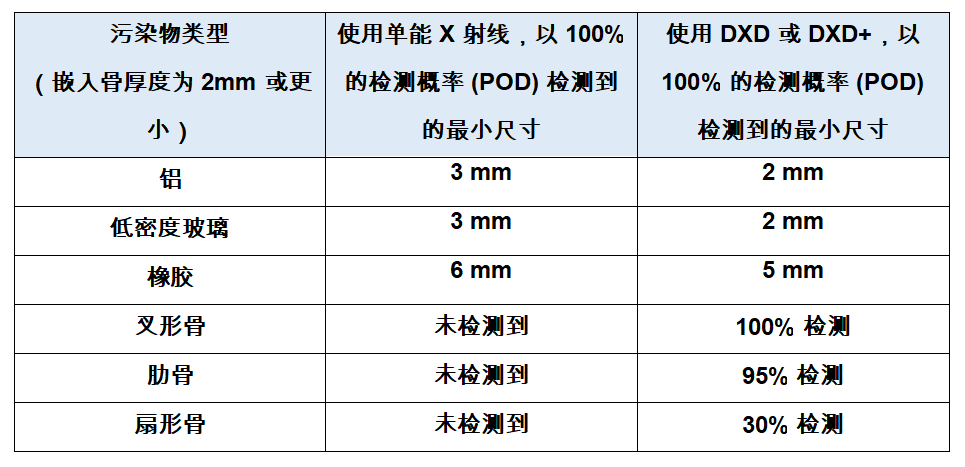 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 挪帝克开设京东旗舰店 与京东全球购达成战略合作
挪帝克开设京东旗舰店 与京东全球购达成战略合作
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!
 沃尔玛食品安全协作中心首次发布《愿景报告》
沃尔玛食品安全协作中心首次发布《愿景报告》
 全球食品创新平台第五期项目甄选火热展开
全球食品创新平台第五期项目甄选火热展开






参与评论