门头沟区腹泻病例来源副溶血性弧菌和沙门氏菌主动监测、
□ 王志越 吕秋艳 褚添 宋景红 刘海涛 庄国良 曹殿起 付慧英 北京市门头沟区疾病预防控制中心
摘 要:依托北京市食源性疾病主动监测体系,开展了解北京市门头沟区食源性疾病腹泻病例来源的副溶血性弧菌、沙门氏菌分子特征和血清学分型。2014年4月~2015年3月,对北京门头沟区食源性疾病监测分离到的副溶血弧菌和沙门氏菌进行PFEG分子分型和图谱分析。11株副溶血弧菌经PFEG分型后,得到10个不同的带型,带型间相似度在0%~84.6%之间;21株沙门氏菌获得16种带型,带型间相似度在20.8%~88.9%之间菌株,部分菌株具有高度同源性,但总体遗传特证多样。门头沟区食源性疾病病例的部分副溶血弧菌和沙门氏菌的分子分型具有一定的相似度,菌株分子特征呈现遗传多样性,说明建立门头沟区食源性疾病病原菌分子分型图谱库,对于食物中毒快速检测、诊断及溯源具有重大意义。关键词:食源性疾病 腹泻 副溶血弧菌 沙门氏菌 分子分型
食源性疾病作为全球主要的公共卫生问题之一,其危害程度和导致的损失呈现逐年递增的趋势,食品中侵染的致病生物因子是食源性疾病暴发的主要病原和诱因。我国食源性疾病的发生往往是由细菌性微生物引起,伤寒沙门氏菌(Salmonella typhosa)、副溶血性弧菌(Vibrio parahemolyticus)和志贺氏菌(Shigella spp)是主要的3类食源性致病菌[1]。副溶血弧菌(Vi. parahemolyticus)作为一种嗜盐性弧菌,已成为我国最主要的食源性水产品致病菌[2],也是近20年来我国食源性疾病暴发的最常见的病原菌[3]。同时,沙门氏菌病也是世界范围主要的的食源性疾病之一,主要是摄入沙门氏菌污染的肉、蛋、奶等动物源性食品而导致食源性疾病的暴发,患者多表现为腹泻、发热、腹痛或痉孪、呕吐、头痛和恶心等典型症状[4]。副溶血弧菌、沙门氏菌频繁导致食源性疾病的暴发,凸显了食源性疾病来源的副溶血弧菌、沙门氏菌的主动监测以及分子分型和溯源防控的重要性。
食源性致病菌分子溯源通过对病人中食源性致病菌分离株进行分子分型和比对分析,开展分布调查和追踪溯源,能够早期发现和识别聚集性病例和暴发线索,对于食源性致病菌监测,传染源追踪、传播途径调查和识别等暴发调查以及防控措施制定实施有着非常重要的意义。本文针对门头沟区食源性疾病主动监测哨点医院诊断病例为监测对象,采集符合食源性疾病病例病人的大便样本,进行副溶血弧菌、沙门氏菌的监测和分子分型溯源,对于全面了解门头沟区副溶血弧菌、沙门氏菌的分子流行病学特点,及时识别聚集性病例和暴发线索,制定合理的控制预防措施,提供科学依据。
1 材料与方法
1.1 菌株来源
1.1.1 监测点设置
选取北京市门头沟区医院、京煤集团总医院作为食源性疾病来源的副溶血弧菌、沙门氏菌的主动监测点,诊断医生根据病例定义筛选病人进行监测样本的采集,北京市门头沟疾控中心微生物检验科负责副溶血弧菌、沙门氏菌的检测、鉴定,分子分型由北京市疾控中心完成。
1.1.2 病例定义[5]
由食品或怀疑由食品引起的,以腹泻症状为主诉的就诊病例。腹泻是指每日排便3次或3次以上,且粪便性状异常,如稀便、水样便、粘液便或脓血便等。
1.1.3 样本采集
采集监测病例新鲜粪便1~2g置于无菌塑料便盒中(如采样困难,可采用无菌棉拭子以直肠内采集粪便后,置Cary-Blair运送培养基,室温保存运送,忌冰箱冷藏),2~8℃、4h内检测。2014年4月~2015年3月,共完成350件样本的采集和监测。
1.1.4 主要设备与试剂
弧菌显色培养基、沙门氏菌显色培养基(郑州人福博赛生物技术有限公司);3%氯化钠碱性蛋白胨水、3%氯化钠三糖铁琼脂、嗜盐性试验培养基(0%、3%、6%、8%,北京陆桥技术有限公司);API 20E生化鉴定条、浊度仪(Densimat),梅里埃公司;Seakem Gold琼脂糖,美国Cambrex BioScience Rockland;蛋白酶K,德国Merck;限制性内切酶XbaⅠ,北京六合通经贸有限公司;脉冲场凝胶电泳仪及配套设备、凝胶成像系统均购自美国Bio-Rad;试验用去离子水系统。
1.2 方法
1.2.1 检测方法
参照文献[5]规定的要求,参照GB 4789规定的方法进行病例大便样本的副溶血弧菌、沙门氏菌的检测、鉴定。
1.2.2 PFGE分型及聚类分析
参照国际食源性致病菌分子分型监测网络PulseNet以及2014年食源性疾病监测工作手册中副溶血弧菌和沙门氏菌的PFGE分型的标准操程序进行[6]。副溶血弧菌主要步骤:胶块内染色体DNA的酶切使用内切酶NotⅠ酶切(标准菌株H9812使用XbaⅠ酶切),在CHEE MAPPER脉冲场电泳仪(美国Bio-Rad公司)上电泳(温度14℃、起始转换时间为10s,终止转换时间为35.03s)18h。电泳结束后,1%的EB染色30min,脱色90min后,使用Gel Doc EQ拍摄图像。沙门氏菌的主要步骤:细菌悬液浓度用VITEK浊度仪调至4.0~4.2麦氏浊度;取400μL菌悬液加等量的胶制备胶块;使用XbaⅠ限制性内切酶(40U),37℃酶切3h;缓冲液为0.5×TBE;电泳电压为6V/cm;电泳参数为
2.2~63.8s,19h;胶块电泳后使用GelRed染色,纯水脱色,读取电泳图谱。用BioNumerics软件对电泳图像进行数据分析,构建聚类树状图。聚类图类型根据非加权配对算术平均法构建,条带位置差异容许度设为1.5%。
2 结果
2.1 菌株的基本情况
2014年4月~2015年3月,北京市门头沟区350例主动监测病例样本中,共检测出副溶血弧菌、沙门氏菌食源性致病菌32株,食源性致病菌阳性检出率为9.14%。其中,11例样本副溶血弧菌阳性检出,病例阳性副溶血弧菌检出率为3.14%,在TCBS上呈现典型菌落特征;沙门氏菌阳性检出21例,检出率为6%,生化鉴定符合沙门氏菌特征。说明门头沟区食源性致病菌中副溶血弧菌、沙门氏菌为主要致病菌。
2.2 PFGE分型结果
2.2.1副溶血弧菌的分子分型
分离得到的11株阳性菌株的DNA片段能得到较好的分离,经PFGE分型后得到10株电泳图谱,FR-bjmtg0117未得到明显的条带忽略不计,BioNumerics软件对电泳图谱进行数据分析结果见图1。在74.9%的相似水平,菌株mtgQ-2014-016-FR、mtgQ-2015-0042-FR、mtgQ-2014-081-FR、mtgQ-2014-095-FR分离条带相似度较高,尤其mtgQ-2014-016-FR、mtgQ-2015-0042-FR的相似度84.6%,说明其可能来自同一污染源的菌株,从流行病学的角度考虑,菌株mtgQ-2014-016-FR、和菌株mtgQ-2015-0042-FR导致的食源性疾病可能来自同一菌株所致。菌株FR-bjmtg17-3、FR-bjmtg17-4的条带分布也存在较高的相似度,达到了80%,其他各菌株PFGE 图谱条带差异较大,说明2014~2015年mtgQ-2014-016-FR、和FR-bjmtg17-3带型是门头沟区食源性疾病的副溶血弧菌优势带型。
获得副溶血弧菌的PFGE图谱可以作为北京市门头沟区2014~2015年的副溶血弧菌代表菌株的PFGE图谱数据库,用于副溶血弧菌导致的食源性疾病的溯源、传播途径调查和识别以及预防控制措施的制定实施。

21株沙门菌通过PFGE分型后,共分为16个带型,每个带型包含1~5株菌,2个带型包含菌株>1,分别为2和5株菌株,其他带型均包含1株菌株(图2)。菌株2014mtgQ-116、mtgj-2014-055、mtgj2014-106、mtgQ2015-0011、mtgQ2015-18为同一个带型,而菌株mtgQ-2014-088和mtgQ-2014-088/#1带型相同;说明其病原具有同源性,可能为同一污染源和病原,往往是食源性疾病聚集暴发的因子。16种分子分型条带的相似度为20.8%~88.9%,菌株mtgQ-2015-36和mtgQ2014-118条带相似度达到了90.9%,菌株mtgj-2014-120与mtgQ-2015-017条带相似度为89.7%,且跨年度菌株,说明门头沟区沙门氏菌病人病原相同,污染源相近;菌株mtgQ-2014-088 mtgQ-2014-088/#1、mtgQ-2014-125相似度为88.9%;且为同年度分离获得,说明可能为聚集暴发病例或感染后处置不彻底形成延续病例。
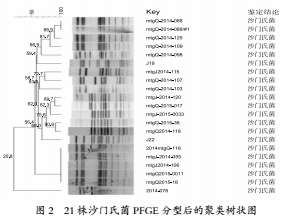
3 讨论
当前,病原微生物污染防控是食品安全的刚性需求,微生物污染是食品不合格和造成食物中毒的主要原因,食源性副溶血弧菌和沙门氏菌是食源性疾病暴发的主要因素之一。而PFGE分子分型方法被认为是细菌分子分型最可靠的手段,能够快速进行致病菌的比对和溯源。FGE结果进行比较,追溯致病食品源头[7]。本研究依托北京市食源性疾病主动监测体系,获得11株副溶血弧菌和21株沙门氏菌阳性菌株,均来自门头沟区食源性疾病主动监测哨点医院,由食品或怀疑由食品引起的,获得PFEG图谱说明,副溶血弧菌具有10种带型,沙门氏菌16种带型。副溶血弧菌的mtgQ-2014-016-FR、mtgQ-2015-0042-FR、mtgQ-2014-081-FR、mtgQ-2014-095-FR菌株条带相似度较高;FR-bjmtg17-3、FR-bjmtg17-4的条带也具有较高的同源性;其他菌株条带差异较大。沙门氏菌菌株16种分子分型条带的相似度为20.8%~88.9%,菌株mtgQ-2015-36和mtgQ2014-118条带相似度达到了90.9%,菌株mtgj-2014-120与mtgQ-2015-017条带相似度为89.7%。
11株副溶血弧菌和21株沙门氏菌的图谱聚类分析显示,门头沟区食源性副溶血弧菌和沙门氏菌的遗传呈现多态性,菌株间的亲缘关系较复杂,且与样本采集时间有关联,与文献报道较一致[8,9]。部分食源性疾病病例分得到的副溶血弧菌和沙门氏菌阳性菌株的PFGE图谱归属于同一群,在遗传学为亲缘较近菌株,图谱条带的差异为菌株发生了单个遗传[10]。北京门头沟区食源性致病菌监测显示,食品中副溶血弧菌检出率最高为22.22%,污染生食动物性水产品[11],沙门氏菌也是食品污染主要致病菌[4]。故本研究结果获得的PFEG图谱,能够为门头沟区食源性疾病沙门氏菌和副溶血弧菌分子分型数据库建立奠定良好的基础,有助于开展沙门氏菌、副溶血弧菌的主动监测、暴发调查、传染源追踪和分子溯源,对于预防和控制食源性副溶血弧菌导致的食源性疾病具有重大现实意义。
参考文献:
[1] 赵怀龙,付留杰,唐功臣.我国主要的食源性致病菌[J].医学动物防制,2012,28(11):1212~1216.
[2] 安静.你吃的食品安全吗?现阶段的食品安全风险[EB/OL]:摘编自旭日干、庞国芳主编《中国食品安全现状、问题及对策战略研究》[C].http://blog.sciencenet.cn/blog-528739-957755.html,2016-1-6.
[3] Yongning Wu,Jian Wen,Yi Ma, et al.Epidemiology of foodborne disease outbreaks caused by Vibrio parahaemolyticus,China,2003~2008[J].Food Control,2014, (46):197~202.
[4] 王军,郑增忍,王晶钰.动物源性食品中沙门氏茵的风险评估[J].中国动物检,2007,24(4):23-25.
[6] 国家食品安全风险评估中心.2014年食源性疾病监测工作手册[C].北京:国家食品安全风险评估中心,2014:8.
[7] 李燕俊,赵熙,杨宝兰,等.肠沙门氏菌脉冲场凝胶电泳分型研究[J].卫生研究,2005,34(3):338-340.
[8] 陈黎,方晔,陈建才.义乌市33株副溶血性弧菌脉冲场凝胶电泳分子分型结果[J].上海预防医学,2015,27(3):134-136.
[9] 邓志爱,李孝权,张健,等.广州市水产品副溶血性弧菌污染状况调查及PFGE分型研究[J]. 中国卫生检验杂志,209,19(5):1130-1132.
[10] Tenover FC,Arbeit RD,Goering RV,et al.Interpreting chrmosomal DNA restrition patterns produced by pulsed2field gel electrophoresis:criteria for bacterial strains t yping[J].J Clin Microbiol,1995,33(9):2233-2239.
[11] 吕秋艳,王志越,宋景红,等.2010~2012年北京市门头沟区食源性致病菌监测结果[J].职业与健康,2014,30(5).

[责任编辑:]

 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
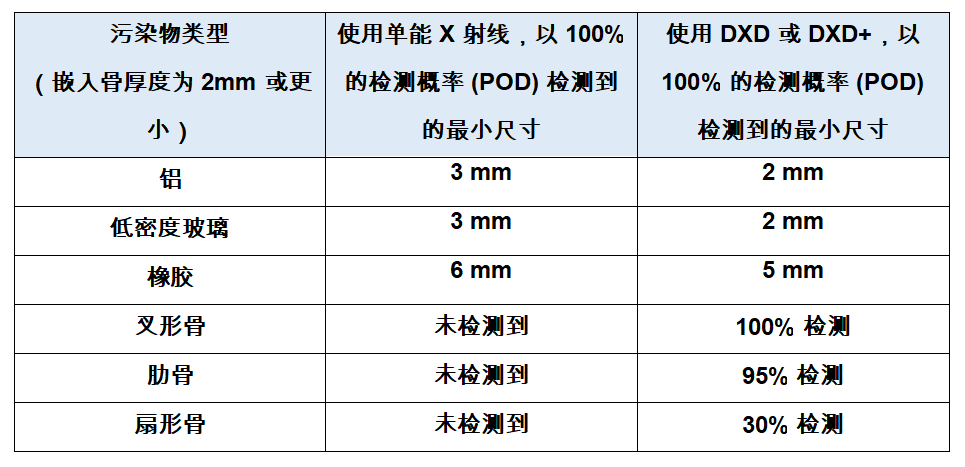 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论