对新修订药品质量验收环节的思考
摘 要:随着我国经济建设步伐的加快,我国对于医药事业的重视程度与日俱增,在2013年六月重新修订了《药品经营质量管理规范》,其中对于药品质量的验收环节提出了严格的要求,笔者通过查阅相关资料与实践经验的总结,对如何加强药品质量的验收进行思考,并提出相应的意见与建议,希望能够促进我国医药事业的不断进步。
关 键 词:药品质量;验收环节;问题思考
《药品经营质量管理规范》简称为GSP,其对于药品经营企业起到一定的规范与约束作用,尤其是新修订的GSP更是注重药品质量检验的各个环节,质量检验人员不仅要严格控制药品入库条件,还要对传统的验收工作有新的思考,从而确保药品的质量安全。
一、新修订药品质量验收环节需注意的问题
1.收货与验收。新修订的GSP不同于传统的药品验收形式,其将收货与验收两个环节分开处理,各自分派收货人员与验收人员负责相关工作,不仅要求人员的综合素质与专业技能,还通过实行责任分配制度来提升工作效率与质量。一方面,收货人员负责确认药物的来源、数量以及运输是否符合规定的要求,同时使用计算机系统准确、高效的验证药品的归属地等信息是否出现错误,再核对供应商的票据,如果出现任何问题都会及时反映到上级部门,并采取有效措施进行处理,这种新的药品入库环节从一开始就将药品质量问题遏制住,为接下来的验收工作打下坚实基础。另一方面,就是对药品质量的验收,验收人员首先对药品的外观质量进行评估,合格后再检查商标、日期、合格文件证明等,传统的药品质量检查并不会上传检测数据,而新修订的GSP对此要求更加严格,验收人员要将检验的结果输入计算机电子监管系统中,只有这样才能为下游企业的发展提供便利,即使发现问题也能够快速的找出原因,但是,这种电子监管系统并没有普及到我国各大药品生产运营企业当中,如何做好药品质量的管理与控制还是值得我们深思。
2.冷链药品的验收。冷链是从药品生产到运输再到批发企业或医疗机构,最后到患者使用的一个封闭的流程,大多数冷链的运营时间较长,很多药品都比较敏感,例如见光分解、吸潮等,这些都会严重影响药效的发挥,因此,在新修订的GSP中,强调了冷链在冷藏、存储以及运输三个环节的管理,从而有效的提升药品的检验质量,让患者获得更加优质的服务,同时,附录中还补充规定了验收、存储、养护、出库等环节的人员配送及法律知识等,企业还要注重相关人员的技能培训,确保冷链供应发挥其应有的价值与意义。另一方面,冷链药品的验收不仅注重药品的数量与来源,还要确保运输条件符合规定的要求,其中冷藏车在使用前要检查,使用后要保养,记录好出发时间、运输时间和运输方式,同时加强温度控制,对于收货过程中所遇到的实际问题还要采取相应的措施解决,而冷链温度记录设备及记录导出设备的研发还需要不断创新,以适应药品检验需求。
3.首营品种的验收。首营的药品是指企业首次购进的药品,新修订的GSP对其验收有着更加广泛的规定,尽管一种新的药品品种是经过大量实践与临床验证才能上市的,但是仍然存在少数的不良反应或质量验收方面的问题,我国已经加大力度控制不法商贩从中谋取私利,也就是通过严格控制药品的入库质量而加强防范。首营品种的验收需要管理部门审核,建立首营档案,同时出示出厂检验报告,但是在实际的检验工作中却经常将备案资料与核对工作忽视,随着我国医药事业的发展壮大,尤其是最近几年,众多的首营药品问市,这无疑增加了药品检验工作的难度,新修订的GSP中将首营品种的信息通过电子档案传输的方式来控制验收环节,但是如何将质量部门的备案资料及时、准确的传递到验收部门也是值得思考的问题。
二、新修订药品质量验收的实施状况
1.得到生产企业的认知与落实。笔者对三十多家样本企业进行新修订药品质量验收的认知调查,其中大多数企业都明显提高了对于软件及硬件的要求,同时增强了验收工作的规范性与可操作性,同时,在人力资源与资金的投入方面也有所增加,要想加强药品质量的验收就应该提升人员专业知识与实践技能,而检验设备的水平也会直接影响药品的检验结果。实际上,新修订的药品质量验收规范也广泛的征求相关部门的意见与建议,帮助明确修订的原则、目的和重点,同时,药品生产企业也在逐步落实新规定中的各项指标,调查结果显示,有百分之九十以上的企业不同程度的完成了改革要求,但是质量风险管理工作还有待加强。
2.新修订药品质量验收全面实施存在的困难。我国新修订的药品质量验收规范参考了欧盟、美国等发达国家的先进经验,在管理思想以及机构组建方面有了实质性的转变,但是,要想全面、有效的实施仍存在较大的难度。首先,对于物料供应商的管理需要进一步规范,药品材料的供应需要进行严格的质量评估,但是我国药品市场良莠不齐,很难将制度全面的覆盖,只能靠药品生产企业严格要求、自觉遵守;其次,样本企业的风险管理还处于起步阶段,这就意味着新修订的药品质量验收环节需要承担一定的风险,加强企业风险管理是提升药品质量的必要手段,其中风险识别、风险评估以及风险沟通等各种管理措施都需要相关部门深入思考;最后,就是药品质量验收的准备工作尚不全面,不能够确保质量控制工作全面、顺利的开展,其中持续稳定性考察、变更控制、偏差处理、产品质量回顾分析、检验结构超标调查等环节都需要规范和加强。
三、结语
综上所述,本研究对我国新修订的药品质量验收环节需要注意的问题及需要深入思考的方向予以阐述,重点介绍了药品的收货、验收以及冷链药品和首营药品的验收,同时将新修订药品质量验收的实施状况进行讨论。药品的质量关乎人民的生命财产安全,是关乎我国民生的大事,因此,药品生产运营企业一定要加强药品的管理与验收,确保我国医药事业健康、稳定发展。
参考文献:
[1]张迎秋.药品流通环节质量风险管理[D].山东大学,2012.
[2]刘枳岑,梁毅.药品生产质量管理规范的变更控制[J].中国药业,2009(18).
[3]马进.对新修订GSP药品质量验收环节的思考[J].北方药学,2013(08).
作者单位:哈药集团哈尔滨医药商业有限公司

[责任编辑:]

相关阅读
- (2015-05-25)药品流通环节质量风险管理
 Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
Mettler-Toledo 在中国国际渔业博览会上展示创新的产品
 食品异物问题频发?是时候了解X射线检测了
食品异物问题频发?是时候了解X射线检测了
 开拓科技创新,撬动橡塑业高质量发展
开拓科技创新,撬动橡塑业高质量发展
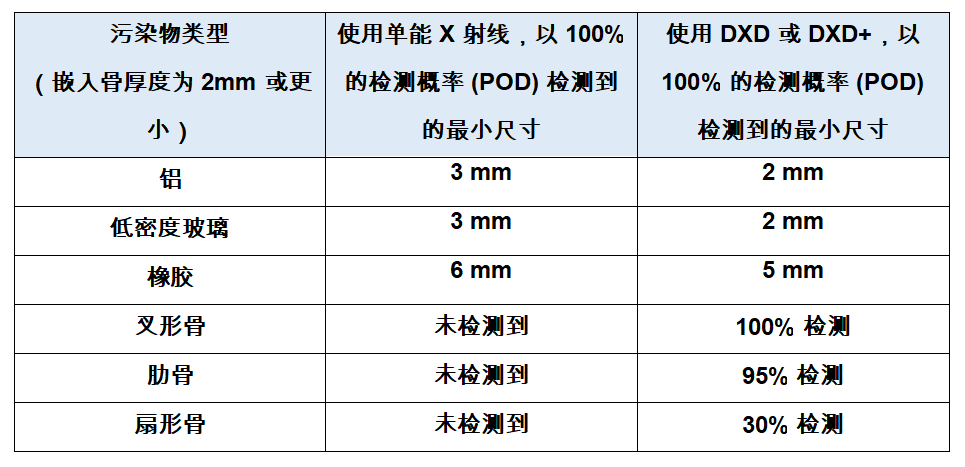 梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
梅特勒托利多针对“难以发现”的污染物推出高品质X射线检
 探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
探索婴幼儿辅食市场高质量发展之路,为宝宝成长保驾护航
 《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
《食品安全最佳实践白皮书(2021-2022年)》四大主题发布
 《保健食品真实世界研究通则》团标技术审查与特食跨
《保健食品真实世界研究通则》团标技术审查与特食跨
 凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
凝聚全球食饮智慧 SIAL西雅展国际化水平再创新高
 精准把控 高质发展,第三届微生物安全与应用会议在
精准把控 高质发展,第三届微生物安全与应用会议在
 《食品行业科技创新白皮书》重磅发布!
《食品行业科技创新白皮书》重磅发布!






参与评论